
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
BABIO ottiene l'autorizzazione 510(k) della FDA statunitense per il suo kit di trasporto di virus (non inattivante)
2025-10-10
BABIO ottiene l'autorizzazione 510(k) della FDA statunitense per il suo kit di trasporto di virus (non inattivante)
Jinan, Cina – ottobre 2025 – Jinan Babio Biotechnology Co., Ltd. (BABIO)annuncia con orgoglio che èKit di trasporto Babio® Virus (non inattivante)ha ufficialmente ricevutoAutorizzazione FDA 510(k) (K250205). Questa certificazione segna una pietra miliare significativa per BABIO, riaffermando il suo impegno per la qualità globale, la sicurezza e l'innovazione nella diagnostica clinica e nei sistemi di trasporto microbiologico.
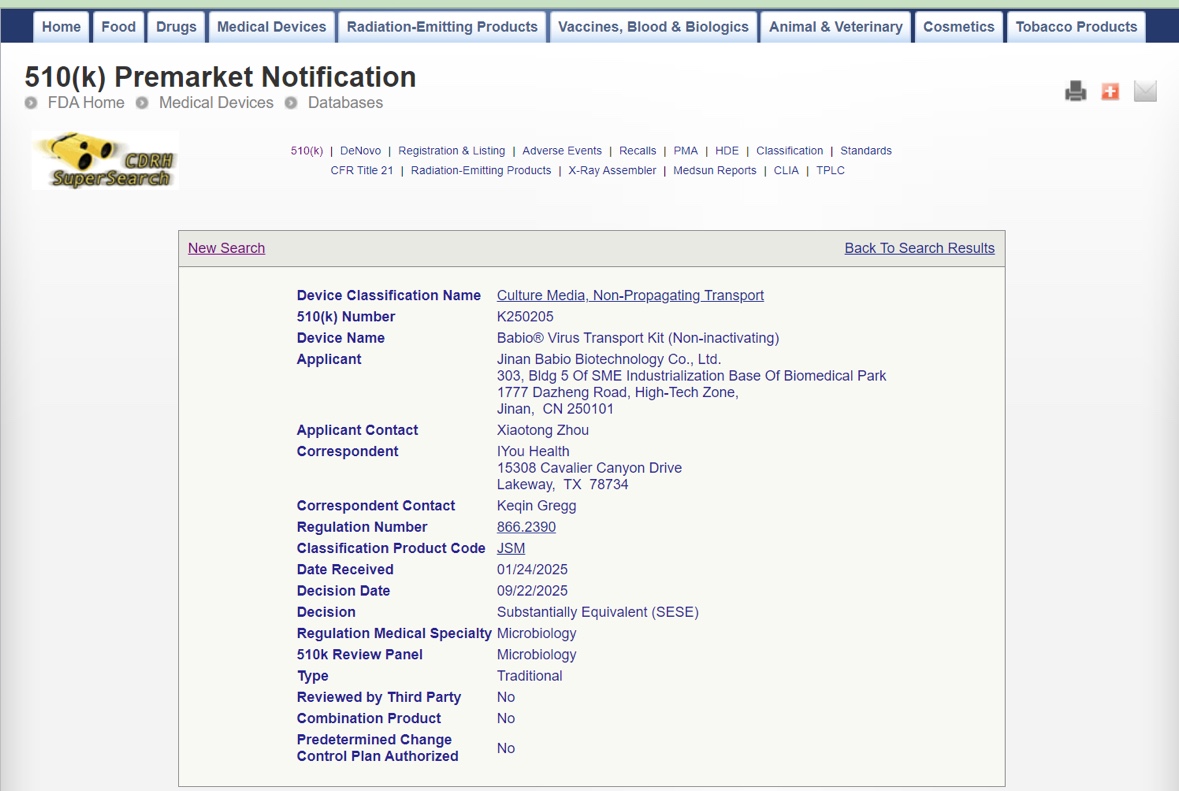
L'autorizzazione 510(k) della FDA autorizza il kit di trasporto Babio® Virus comesostanzialmente equivalentiai dispositivi legalmente commercializzati negli Stati Uniti, convalidandone la conformità agli standard normativi statunitensi per i dispositivi medici. Questo risultato dimostra le forti capacità di ricerca e sviluppo e l’eccellenza produttiva di BABIO, rafforzando ulteriormente la sua competitività globale nel settoremercato del trasporto dei virus e della raccolta dei campioni.
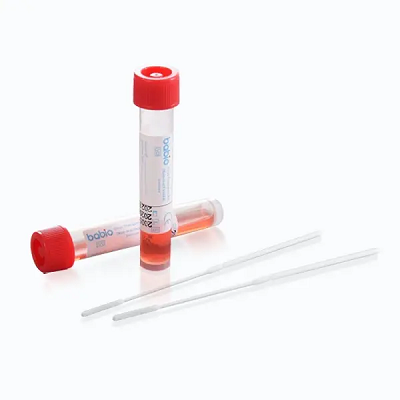
ILKit di trasporto Babio® Virus (non inattivante)è progettato per la raccolta e il trasporto sicuro di campioni clinici contenenti virus. Mantiene l'integrità del campione per i test a valle comeRT-PCR, cultura virale, Ediagnostica molecolare, rendendolo adatto a ospedali, laboratori e istituzioni sanitarie pubbliche in tutto il mondo.

BABIO, aprincipale produttore cinesedi reagenti diagnostici, terreni di trasporto e terreni di coltura, continua ad espandere la sua presenza inEuropa, Stati Uniti, Africa e Sud-Est asiatico, fornendo soluzioni affidabili che soddisfano gli standard internazionali.
Per ulteriori informazioni sui prodotti certificati e sulle innovazioni diagnostiche di BABIO, visitare: https://www.babiocorp.com
#BABIO #FDA510k #VirusTransportKit #MedicalDevices #Diagnostics #BiotechChina #GlobalHealthcare #ClinicalDiagnostics #Microbiology


